肥胖与脂肪质量的增加和脂肪组织的改变有关,目前在一些国家,肥胖被认为是癌症发展的一个独立危险因素。明确肥胖与肿瘤的具体关系是肿瘤生物学领域亟待解决的问题之一,同时也将为肿瘤治疗带来新思路。我院乳甲外科孙圣荣教授团队近期在国际著名肿瘤学期刊Journal of Hematology & Oncology(2018年影响因子:8.731;中科院SCI期刊分区:医学类1区)发表了一篇综述,总结了本课题组近年来在肥胖与肿瘤研究方面的新进展[1-5],揭示了脂肪细胞与肿瘤细胞间的交流与联系。
论文题为“Cancer-associated adipocytes: key players in breast cancer progression”(《癌症相关脂肪细胞:乳腺癌进展中的关键点》)。我院乳甲外科吴奇博士和李贝博士为文章共同第一作者,我院孙圣荣教授、孙思博士为该文章共同通讯作者。

脂肪细胞是一种存在于许多组织中的初级基质细胞,是肿瘤微环境的重要组成部分,研究表明,脂肪细胞可以与肿瘤细胞进行沟通。这些与肿瘤细胞临近的肿瘤相关脂肪细胞(CAAs)可以释放多种细胞因子,改变细胞的表型和功能,最终促进肿瘤的进展。肿瘤细胞将周边正常的脂肪细胞转化为CAAs,然后肿瘤细胞就可以摄取由脂肪细胞分泌的代谢产物,如酮体、脂肪酸、丙酮酸和乳酸等,从而补充自身的营养需求。我院乳甲外科孙圣荣教授团队发表的这篇综述主要聚焦于乳腺癌内的脂肪-肿瘤交流,从炎症、代谢和外泌体这几个角度阐述了CAAs与肿瘤细胞间的相互作用关系。提出CAAs除了对肿瘤细胞有直接作用以外,还通过影响抗肿瘤免疫改变了肿瘤微环境。
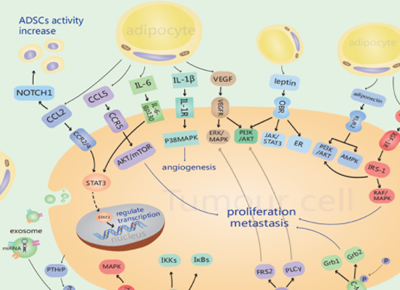
首先CAAs可以分泌炎症因子改变乳腺癌细胞的行为。研究表明,在浸润性乳腺癌的周围基质中存在的CAAs与正常脂肪细胞相比,具有一些特殊的特征,如具有成纤维细胞样的表型、较小的形态、小而分散的脂滴、过表达的VI型胶原蛋白以及低表达的脂联素和其他脂肪因子。CAAS分泌更多的趋化因子CCL 2、CCL 5、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、血管内皮生长因子(VEGF)、瘦素等,对乳腺癌的侵袭和转移有促进作用(图1)。

(图1)
其次CAAs的代谢重塑推动了癌症的进展。脂肪细胞在与乳腺癌细胞相互作用后,就变成了一个能量储存库,为肿瘤细胞提供各种高能量代谢产物。据推测肿瘤细胞可以通过与CAAs的相互作用诱导脂肪细胞代谢重塑,并使其适应新的代谢过程来进行增殖。而且在脂肪细胞内发生的代谢重塑调控了包含碳水化合物、脂质和氨基酸在内的几乎所有大分子营养物质的代谢(图2)。

(图2)
此外还有外泌体在CAAs与肿瘤细胞的交流中也起到了重要作用。在先前的研究中,孙圣荣教授团队已经揭示了脂肪细胞与肿瘤细胞之前存在各种联系,近年来在这一领域发表过数篇文章:1. 证明了外泌体中miR-155的转移作为致癌信号,重塑能量代谢过程并导致乳腺癌中与癌症相关的恶病质(Breast cancer-released exosomes trigger cancer-associated cachexia to promote tumor progression. Adipocyte. 2019 Dec;8(1):31-45. 影响因子:3.533)。2. 单羧酸转运蛋白通过乳腺癌细胞和脂肪细胞之间的相互作用在侵袭性乳腺癌亚型中发挥作用(Monocarboxylate transporters in breast cancer and adipose tissue are novel biomarkers and potential therapeutic targets. BiochemBiophys Res Commun. 2018 Jul 2;501(4):962-967. 影响因子:2.705)。3. 脂肪组织来源的干细胞可以减少外泌体中的胶原沉积和瘢痕形成,p38 / MAPK信号通路的调节在该过程中起重要作用(Adipose tissue-derived stem cells inhibit hypertrophic scar (HS) fibrosis via p38/MAPK pathway. J Cell Biochem. 2019 Mar;120(3):4057-4064. 影响因子:3.448)。4. 通过诱导白色/棕色转化并增强受体脂肪细胞中的分解代谢,来自肿瘤-脂肪细胞相互作用的外泌体中的miRNA-144和miRNA-126可以重塑能量代谢以促进肿瘤进展(Exosomes from the tumour-adipocyte interplay stimulate beige/brown differentiation and reprogram metabolism in stromal adipocytes to promote tumour progression. J ExpClin Cancer Res. 2019 May 28;38(1):223. 影响因子:5.646)。5. 癌细胞分泌的miR-155通过下调PPARγ表达促进脂肪细胞中的白色/棕色转化和重塑代谢并加速癌症相关的恶病质以促进肿瘤进展(Tumour-originated exosomal miR-155 triggers cancer-associated cachexia to promote tumour progression. Mol Cancer. 2018 Oct 25;17(1):155. 影响因子:10.679)。而本文正是基于这些研究基础,对CAA相关研究做出总结,同时也为未来更深入的研究及新的研究方向提供了依据和思路。
在肥胖个体中,肿瘤细胞和脂肪细胞具有明确的临床相关性,这有助于加深我们对乳腺癌发病机制的认识。新药的开发可以直接以脂肪细胞或癌细胞为靶点,也可用于辅助治疗以达到治疗的最大效果。因为肥胖会影响癌症的发生发展,可能会削弱癌症治疗的疗效。对于肥胖来说,饮食控制和锻炼可能是最简单和最有效的治疗策略。
该工作得到了国家自然科学基金和国家重大科学仪器和设备开发项目的支持。
文献来源:Wu Q, Li B, Li Z, Li J, Sun S, Sun S:Cancer-associated adipocytes: key players in breast cancer progression.J HematolOncol. 2019 Sep 10;12(1):95. doi: 10.1186/s13045-019-0778-6.





 武汉大学人民医院
武汉大学人民医院 湖北省人民医院
湖北省人民医院